Pasos 1,2,3 y 4 Podemos suponer que el proceso por lotes global ocurre con Q = 0 y W = 0 si definimos el sistema como en la figura E5.14. Sea T2 la temperatura final. El sistema consiste en 20 lb de H2O en una o dos fases, ΔK= ΔP =0. El balance de energía se reduce a ΔU =0.
Las propiedades iniciales se pueden obtener de las tablas de vapor de agua. Desafortunadamente, si utilizamos unidades del sistema estadounidense sólo podemos obtener valores de ΔH, no los valores de ΔU que queremos (y que podríamos obtener de las tablas de vapor de agua en el SI) para el balance de energía, así que también necesitamos valores para p y para V.
Etiquetas
Buscador
martes, 31 de marzo de 2015
lunes, 30 de marzo de 2015
Ejemplo 2 Balance de Energía
Diez libras de agua a 35°F, 4.00lb de hielo a 32°F y 6.00 lb de vapor de agua a 250°F y 20psia se mezclan en un recipiente de volumen fijo. Cuál es la temperatura final de la mezcla? Cuánto vapor de agua se condensa? Suponga que el volumen del recipiente es constante con un valor igual al volumen inicial del vapor de agua y que el recipiente está aislado. Suponga que se trata de un proceso por lotes, no continuo.
domingo, 29 de marzo de 2015
Solución Aplicación del balance de energía
Solución
No hay reacción. El hecho de que la bobina del calentador se "caliente" dentro del sistema no significa que haya transferencia de calor al sistema. El sistema no intercambia masa con el entorno, así que puede aplicarse la ecuación (5.11) con ΔK = ΔP = 0
No hay reacción. El hecho de que la bobina del calentador se "caliente" dentro del sistema no significa que haya transferencia de calor al sistema. El sistema no intercambia masa con el entorno, así que puede aplicarse la ecuación (5.11) con ΔK = ΔP = 0
sábado, 28 de marzo de 2015
Ejemplo Aplicación del balance de energía
En una cámara de deposición de plasma con un volumen de 2L se va a calentar gas argón con un calentador de resistencia eléctrica. En un principio el gas, que puede tratarse como gas ideal, está a 1.5 Pa y 300 K. El calentador de 1000 ohms extrae corriente a 40 V durante 5 minutos (o sea, el entorno se raliza 480 J de trabajo). Cuál es la temperatura y la presión finales del gas de equilibrio?. La masa del calentador es de 12g y su capacidad calorífica es de 0.35 J/(g mol)(K). Suponga que la transferencia de calor del gas a la cámara insignificante a esta presión tan baja y en un tiempo tan corto es.
viernes, 27 de marzo de 2015
Solución Aplicación del balance de energía
Este problema implica un sistema cerrado (Fig. E5.12) sin reacción, así que se puede aplicar la ecuación (5.11). Podemos usar la carta de CO2 del apéndice J para obtener los valores de propiedades necesarios.
Pasos 1,2,3 y 4 El volumen específico del CO2 es de 4.0/10 = 0.40 ft³/lb, de modo que el CO2 está en estado gaseoso al principio del proceso. La presión es de 300 psia y ΔH = 160Bt/lb
Pasos 1,2,3 y 4 El volumen específico del CO2 es de 4.0/10 = 0.40 ft³/lb, de modo que el CO2 está en estado gaseoso al principio del proceso. La presión es de 300 psia y ΔH = 160Bt/lb
jueves, 26 de marzo de 2015
Ejemplo Aplicación del balance de energía
Diez libras de CO2 a temperatura ambiente (80°F) se almacenan en un extintor de incendios que tiene un volumen de 4.0ft³. Cuánto calor se deberá extraer del extintor para que el 40% del CO2 se encuentre en estado líquido.?
miércoles, 25 de marzo de 2015
Sistemas Cerrados
A fin de aclarar aún más los términos del balance de energía considere un sistema cerrado en el que el balance de energía se reduce a Q + W = ΔE. Esta ecuación se aplica con referencia llamado sistema de centro de masa. Suponga que el sistema es el fluido contenido en un frasco Dewar (para que Q=0). Puesto que el fluido no puede desplazar las parades del frasco, W=0. Además, suponga que una pelota adherida al interior de la tapa del frasco se libera de alguna manera (con un gasto insignificante de energía) y cae hasta el fondo del frasco. Qué cambios ocurren en el sistema? Recuerde que ΔE = ΔU + ΔP + ΔK. La caída de la pelota cambia del dentro de masa del fluido, de modo que ΔP baja y entonces ΔU y la temperatura fluida suben, aunque desde luego no mucho. El aumento en la temperatura del fluido no se debió a transferencia de calor, porque por definición Q es la transferencia de energía a través de la frontera del sistema. Al caer la pelota, la gravedad no realiza trabaja alguno, porque la frontera debe moverse para que haya W.
martes, 24 de marzo de 2015
Aplicaciones del balance general de energía sin ocurrencia de reacciones - Conceptos Principales (V)
Para facilitar la resolución de problemas en los que intervienen balances de energía, conviene agregar dos pasos más a la lista mental que debe verificar al analizar los problemas
1) Paso 7a: Siempre escriba el balance de energia general debajo de su dibujo. Así se asegurará de no olvidar ninguno de los términos en su análisis.
2) Paso 7b: Examine cada uno de los términos del balance de energía general y elimine todos los que sean cero o que puedan ignorarse. Escriba las razones para hacerlo.
A continuación examinaremos algunas aplicaciones del balance de energía general, primero a sistemas cerrados y luego a sistemas abiertos.
1) Paso 7a: Siempre escriba el balance de energia general debajo de su dibujo. Así se asegurará de no olvidar ninguno de los términos en su análisis.
2) Paso 7b: Examine cada uno de los términos del balance de energía general y elimine todos los que sean cero o que puedan ignorarse. Escriba las razones para hacerlo.
A continuación examinaremos algunas aplicaciones del balance de energía general, primero a sistemas cerrados y luego a sistemas abiertos.
lunes, 23 de marzo de 2015
Aplicaciones del balance general de energía sin ocurrencia de reacciones - Conceptos Principales (IV)
Merece la pena recordar los nombres de algunos tipos de procesos especiales asociados a los problemas de balance de energía:
- Isotérmico (dT = 0); proceso a temperatura constante
- Isobárico (dp = 0); proceso a presión constante
- Isométrico o isocórico (dV = 0); proceso a volumen constante.
- Adiabático (Q=0: no hay intercambio de calor (es decir, el sistema está aislado). Si queremos saber en qué circunstancia se puede calificar un proceso como adiabático, las siguientes son las más probables:
a) El sistema está aislado.
b) Q es muy pequeño en relación con los demás términos de la ecuación de energía y puede ignorarse.
c) El proceso ocurre con tal rapidez que no hay tiempo de transferir calor.
domingo, 22 de marzo de 2015
Aplicaciones del balance general de energía sin ocurrencia de reacciones - Conceptos Principales (III)
Tenemos, por ejemplo, el sistema de flujo que se muestra en la figura 5.9. Si consideramos globalmente el sistema entre los puntos 1 y 5, veremos que ΔP = 0. De hecho, la única porción del sistema en la que nos interesaría ΔP sería entre el punto 4 y algún otro punto. Entre 3 y 4, ΔP puede ser importante, pero entre 2 y 4 puede ser insignificante en comparación con el trabajo introducido por la bomba. Entre el punto 3 y cualquier otro punto corriente abajo, tanto Q como W son cero. Después de leer los enunciados del problema que se dan a continuación, pero antes de continuar con la lectura de la solución, trate de aplicar la ecuación (5.13) para evaluar su capacidad para simplificar el balance de energía en casos específicos.
sábado, 21 de marzo de 2015
Aplicaciones del balance general de energía sin ocurrencia de reacciones - Conceptos Principales (II)
1) No hay transferencia de masa (sistema cerrado o por lotes) (m1 = m2 = 0):
ΔE = Q + W
2) No hay acumulación (ΔE = 0) ni transferencia de masa (m1 = m2 = 0):
Q = -W
3) No hay acumulación (ΔE = 0 ) pero si el flujo de masa:
Q + W = Δ[(H+K+P)m]
4) No hay acumulación, Q = 0, W = 0, K = 0, P = 0
ΔH = 0
ΔE = Q + W
2) No hay acumulación (ΔE = 0) ni transferencia de masa (m1 = m2 = 0):
Q = -W
3) No hay acumulación (ΔE = 0 ) pero si el flujo de masa:
Q + W = Δ[(H+K+P)m]
4) No hay acumulación, Q = 0, W = 0, K = 0, P = 0
ΔH = 0
viernes, 20 de marzo de 2015
Aplicaciones del balance general de energía sin ocurrencia de reacciones - Conceptos Principales
En la mayor parte de los problemas no hay necesidad de usar todos los términos de la ecuación del balance de energía general porque algunos de ellos pueden ser cero o tan pequeños que resultan insignificantes en comparación con los demás términos. Podemos deducir varios casos especiales que tienen una importancia industrial considerable a partir del balance de energía general si introducimos ciertas suposiciones simplificadoras.
jueves, 19 de marzo de 2015
Aplicaciones del balance general de energía sin ocurrencia de reacciones - Temas por tratar
En esta sección aplicaremos el balance de energía de la ecuación (5.10), escrito en símbolos como en la ecuación (5.11) o en la (5.13) a sistemas cerrados y abiertos, respectivamente. Los balances de materia no serán importantes en esta presentación.
miércoles, 18 de marzo de 2015
Aplicaciones del balance general de energía sin ocurrencia de reacciones
Sus objetivos al estudiar esta sección ser capaz de:
- Escribir el balance de energía general en palabras y símbolos para sistemas abiertos y cerrados.
- Aplicar el balance de energía general para resolver problemas específicos.
- Simplificar la ecuación del balance de energía de acuerdo con el enunciado del problema y otra información.
martes, 17 de marzo de 2015
Ideas Clave Cálculo de cambios de entalpía
- Podemos calcular o consultar los cambios de entalpía empleando diversas fuentes que incluyen las ecuaciones de capacidad calorífica, tablas, diagramas y bases de datos, entre otras.
- Las ecuaciones de capacidad calorífica se pueden desarrollar a partir de datos experimentales e integrarse para calcular los cambios de entalpía en una sola fase.
- Las tablas y diagramas proporcionan los cambios de entalpía para una fase y además incluyen las transiciones de fase.
- Las transiciones de fase como el calor de vaporización o de fusión deben ser lo más precisas que sea posible, porque representan cantidades grandes en el balance de energía.
lunes, 16 de marzo de 2015
En Retrospectiva Cálculo de cambios de entalpía
En esta sección describimos cuatro formas comunes de obtener los valores de la entalpía para sustancias puras: ecuaciones de capacidad calorífica, tablas, diagramas y bases de datos.
domingo, 15 de marzo de 2015
Predicción empleando la entalpía de vaporización en el punto de ebullición normal
sábado, 14 de marzo de 2015
Ecuación de Chen
Una ecuación que produce valores de ΔHv (en kJ/g mol) con una exactitud del 2% es la ecuación de Chen
viernes, 13 de marzo de 2015
Detalles adicionales
La ecuación de Clapeyron es una relación termodinámica exacta entre la pendiente de la curva de presión de vapor y el calor molar de vaporización y las demás variables que se enumeran a continuación:
jueves, 12 de marzo de 2015
Recuperación de datos de bases de datos computarizados
Los valores de las propiedades de miles de sustancias están disponibles en forma de programas para computadora que pueden proporcionar los valores en cualquier estado dado, con lo que se evita la necesidad de realizar interpolaciones o cálculos auxiliares, como cuando sólo es preciso calcular ΔH a partir de ΔU = ΔH - ΔpV. Uno de estos programas, el crrespondiente a las propiedades del agua, está incluido en el disco que acompaña a este blog. El programa está condensado, así que no tiene ni la exactitud ni la amplitud de cobertura de los programas comerciales, pero basta y sobra para resolver los problemas de este blog. El profesor Yaws ha tenido la bondad de proporcionar datos para calcular los calores de vaporización de 700 compuestos; examine el disco que acompaña a este blog.
Es posible adquirir paquetes computacionales que proporcionen información sobre las propiedades fisicas de un gran número de compuestos, y también se puede tener acceso inmediato a los sistemas de información computarizados a través de la Internet. Al final del capítulo se incluye una lista de programas y bases de datos útiles.
Es posible adquirir paquetes computacionales que proporcionen información sobre las propiedades fisicas de un gran número de compuestos, y también se puede tener acceso inmediato a los sistemas de información computarizados a través de la Internet. Al final del capítulo se incluye una lista de programas y bases de datos útiles.
miércoles, 11 de marzo de 2015
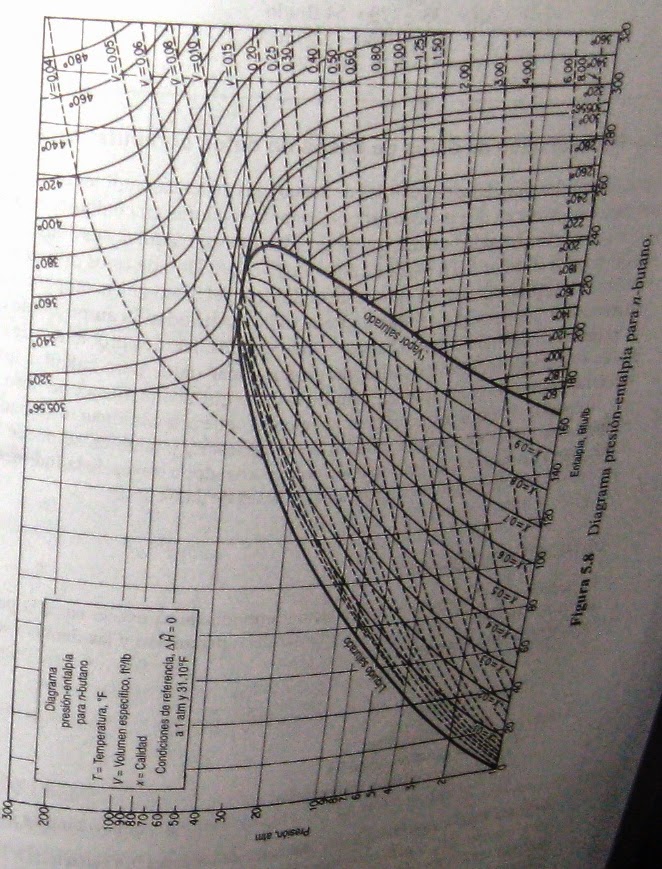
Solución Uso del diagrama de presión-entalpía para el butano
martes, 10 de marzo de 2015
Ejemplo Uso del diagrama de presión-entalpía para el butano
Calcule los cambios ΔH, ΔV y ΔT para 1 lb de vapor saturado de n-butano que pasa de 2 atm a 20 atm (saturado)
lunes, 9 de marzo de 2015
Cuántas propiedades es necesario especificar par aun gas componente si queremos fijar definitivamente su estado?
Si específicamos dos propiedades intensivas para un gas puro, garantizaremos que las demás propiedades intensivas tendrán valores definidos y podremos elegir cualesquier dos propiedades intensivas. Dado que podemos definir un estado en particular de un gas con dos propiedades independientes cualesquiera, es evidente que un diagrama bidimensional resulta múy útil para presentar muchas combinaciones de propiedades físicas.
domingo, 8 de marzo de 2015
Presentación gráfica de los datos de entalpía
Todos hemos oído el dicho "una imagen vale por mil palabras". Algo similar podría decirse de los diagramas bidimensionales, es decir, podemos darnos una idea excelente de las características de la entalpía y de otras propiedades de una sustancia en todas las regiones de interés por medio de un diagrama. Aunque la exactitud de las lecturas de valores puede ser limitada (dependiendo de la escala del diagrama), el trazo de diversos procesos en un diagrama nos permite visualizar y analizar rapidamente lo que está sucediendo. No hay duda de que los diagramas son un método sencillo y rápido de obtener datos para calcular los cambios de entalpía. La figura 5.8 es un ejemplo.
Los diagramas se dibujan con diversas coordenadas, como p contra H, p contra V o p contra T. Puesto que un diagrama sólo tiene dos dimensiones, las coordenadas sólo pueden representar dos variables. Las demás variables de interés se grafican como líneas de valor constante. Recuerde, por ejemplo que en el diagrama de p-V para el CO2 se mostraban lineas de temperatura constante como parámetros. De manera similar, en un diagrama con la presión y la entalpía como ejes, se pueden dibujar líneas de volumen específico y/o temperatura constantes, como en la figura 5.8.
Los diagramas se dibujan con diversas coordenadas, como p contra H, p contra V o p contra T. Puesto que un diagrama sólo tiene dos dimensiones, las coordenadas sólo pueden representar dos variables. Las demás variables de interés se grafican como líneas de valor constante. Recuerde, por ejemplo que en el diagrama de p-V para el CO2 se mostraban lineas de temperatura constante como parámetros. De manera similar, en un diagrama con la presión y la entalpía como ejes, se pueden dibujar líneas de volumen específico y/o temperatura constantes, como en la figura 5.8.
sábado, 7 de marzo de 2015
Solución Ejemplo uso de las tabla de vapor de agua
Podemos ignorar el efecto de la presión sobre el volumen del agua líquido (si desea verificar esto consulte la tabla de las propiedades del agua líquida), así que el volumen específico inicial es el del agua líquida saturada a 300 K, o sea, 0.001004 m³/kg. El volumen específico final es
0.001004(1000) = 1.004 m³/kg
A 200 kPa, e interpolando entre 400 y 450 K, lo que cubre el intervalo del volumen específico de 1.004 m³/kg, obtenemos T resolviendo
0.001004(1000) = 1.004 m³/kg
A 200 kPa, e interpolando entre 400 y 450 K, lo que cubre el intervalo del volumen específico de 1.004 m³/kg, obtenemos T resolviendo
viernes, 6 de marzo de 2015
Ejemplo uso de las tabla de vapor de agua
SE enfría vapor de agua de 640°F y 92 psia a 480°F y 52 psia. Cuál es el valor de ΔH en Btu/lb?
jueves, 5 de marzo de 2015
Solución Calculo del cambio de entalpía de un gas empleando valores de entalpía tabulados (II)
Podemos encontrar la región en al que se encuentra un estado en particular consultando una de las dos tablas de las propiedades de saturación. Si, a la T o p dada, la propiedad intensiva específica dada queda fuera del intervalo de propiedades que pueden existir para el líquido saturado, el vapor saturado o sus mezclas, entonces el estado deberá estar en la región supercalentada o bien en la subenfriada. Por ejemplo, examine el siguiente extracto de las tablas de vapor de agua en unidades del SI (de la hoja plegada de la contraportada):
Para cada presión de saturación, se indica la temperatura de saturación correspondiente (punto de ebullición) junto con los valores del volumen específico y la entalpía, tanto para el líquido saturado como para el vapor saturado. Los valores de volumen y entalpía de la columna designada con el subíndice lg es la diferencia entre los valores correspondientes a los estados de vapor saturado y líquido saturado.
Para cada presión de saturación, se indica la temperatura de saturación correspondiente (punto de ebullición) junto con los valores del volumen específico y la entalpía, tanto para el líquido saturado como para el vapor saturado. Los valores de volumen y entalpía de la columna designada con el subíndice lg es la diferencia entre los valores correspondientes a los estados de vapor saturado y líquido saturado.
miércoles, 4 de marzo de 2015
Solución Calculo del cambio de entalpía de un gas empleando valores de entalpía tabulados (I)
Como 100 kPa es prácticamente 1 atm, las tables del apéndice D pueden servir para calcular el cambio de entalpía.
En este blog, el elector encontrará dos conjuntos de tablas de vapor de agua, uno en SI en la hoja doblada incluida en una bolsa dentro de la contraportada y otro dividido entre e apéndice X y la hoja doblada. Para usar estas tables es preciso primero localizar la región de las propiedades fisicas que interesan. LAs tablas están organizadas de tal modo que las propiedades de saturación se dan aparte de las propiedades de vapor de agua supercalentada y del líquido subenfriado. Además, las propiedades de saturación se listan de dos maneras: 1) la presión de saturación se indica a intervalos regulares para facilitar la interpolación y 2) la temperatura de saturación se da a intervalos regulares por la misma razón.
En este blog, el elector encontrará dos conjuntos de tablas de vapor de agua, uno en SI en la hoja doblada incluida en una bolsa dentro de la contraportada y otro dividido entre e apéndice X y la hoja doblada. Para usar estas tables es preciso primero localizar la región de las propiedades fisicas que interesan. LAs tablas están organizadas de tal modo que las propiedades de saturación se dan aparte de las propiedades de vapor de agua supercalentada y del líquido subenfriado. Además, las propiedades de saturación se listan de dos maneras: 1) la presión de saturación se indica a intervalos regulares para facilitar la interpolación y 2) la temperatura de saturación se da a intervalos regulares por la misma razón.
martes, 3 de marzo de 2015
Ejemplo Calculo del cambio de entalpía de un gas empleando valores de entalpía tabulados
Calcule el cambio de entalpía de 1 kg mol de N2 gaseoso que se calienta a una presión constante de 100 kPa desde 18°C hasta 1100°C.
lunes, 2 de marzo de 2015
Tablas de valores de entalpía
Las tablas pueden cubrir con exactitud intervalos de propiedades fisicas mucho más amplios que las ecuaciones individuales. Puesto que las propiedades que se miden con mayor frecuencia son la temperatura y la presión, las tablas de entalpías (y energías internas) para los compuestos puros por lo regular se organizan en columnas y filas, con T y p como variables independientes. Si los intervalos entre las entradas de la tabla no son muy amplios, una interpolación lineal entre dos entradas de la tabla tendrá una exactitud aceptable.
A continuación describiremos de dos tipos de tablas que usaremos en este capítulo. El primer conjunto es el de tablas de entalpías de gases a 1 atm, que puede encontrarse en el apéndice D. Los valores de las entalpías son sólo para la fase gaseosa. Las tablas de vapor de agua representan el segundo tipo de tablas, a saber, tablas que incluyen entalpías de cambios de fase junto con las entalpías de una sola fase. Recuerde que todos los valores de entalpía son relativos a algún estado de referencia. Podemos calcular las diferencias de entalpía restando la entalpía inicial de la final para cualesquier dos conjuntos de condiciones, como se muestra en el siguiente ejemplo.
A continuación describiremos de dos tipos de tablas que usaremos en este capítulo. El primer conjunto es el de tablas de entalpías de gases a 1 atm, que puede encontrarse en el apéndice D. Los valores de las entalpías son sólo para la fase gaseosa. Las tablas de vapor de agua representan el segundo tipo de tablas, a saber, tablas que incluyen entalpías de cambios de fase junto con las entalpías de una sola fase. Recuerde que todos los valores de entalpía son relativos a algún estado de referencia. Podemos calcular las diferencias de entalpía restando la entalpía inicial de la final para cualesquier dos conjuntos de condiciones, como se muestra en el siguiente ejemplo.
domingo, 1 de marzo de 2015
Solución Cálculo de ΔH para una mezcla de gases empleando ecuaciones de capacidad calorífica
Suscribirse a:
Entradas (Atom)